Nature Communications—方玉达/涂晓雨团队合作揭示组蛋白H2A通过cohesin靶向进行单泛素化修饰的机制
核小体是染色质的基本组成部分,由146 bp的DNA缠绕组蛋白八聚体(H2A-H2B和H3-H4二聚体)构成。组蛋白的N端尾部能进行多种翻译后修饰,包括甲基化、乙酰化、磷酸化、泛素化等。这些修饰通过改变染色质结构来影响DNA复制、转录和损伤修复等各种基因组功能。组蛋白H2A单泛素化修饰(H2Aub1)在真核生物中非常保守,且在基因组上广泛分布,其对基因表达和细胞特征维持发挥了重要的功能。在拟南芥中,多梳抑制复合物(Polycomb-repressive complex 1, PRC1)中AtBMI1A/B/C和AtRING1A/B两类泛素连接酶亚基对H2A第121位赖氨酸进行单泛素化修饰,但是PRC1组分缺乏DNA结合域,泛素连接酶如何与DNA结合并对特定基因组位点上的核小体组分H2A进行单泛素化修饰是亟待解决的科学问题。

2023年3月3日,bat365在线平台官网方玉达教授团队和涂晓雨副教授团队以及同济大学生命科学与技术学院江赐忠教授团队在Nature Communications发表了题为Histone H2A monoubiquitination marks are targeted to specific sites by cohesin subunits in Arabidopsis的研究论文,揭示了拟南芥cohesin蛋白复合体亚基AtSYN4和AtSCC3与AtBMIs构成“分子桥”,介导组蛋白H2A进行基因组定点单泛素化修饰的分子机制。
Cohesin是真核生物中保守的蛋白复合体,由染色体结构维持蛋白(Structural Maintenance of Chromosome,SMC)SMC1与SMC3、姐妹染色单体黏连蛋白(SISTER CHROMATID COHESION)SCC3和α-kleisin家族蛋白组成为环状结构。在细胞有丝分裂和减数分裂期,cohesin参与染色质形态维持并保证染色体有序地分配进入子细胞。在细胞间期,cohesin充当染色质“成环”的脚手架,介导增强子-启动子或绝缘子-启动子之间的交互作用,参与染色质三维空间结构的产生和维持,并以此调控基因的转录。
拟南芥有1个SCC3蛋白(AtSCC3)和4个α-kleisin类蛋白(AtSYN1-4)。在这项研究中,作者发现了拟南芥cohesin两个亚基(AtSYN4与AtSCC3)之间以及AtSCC3与泛素连接酶AtBMIs之间有直接相互作用。因此,AtSCC3作为分子桥梁,介导了AtSYN4-AtSCC3-AtBMIs桥接复合体的形成。进一步发现atsyn4突变体与atscc3的RNAi敲低植株中整体H2Aub1水平降低。通过atsyn4突变体、atscc3的RNAi系与atbmi1a/b/c突变体转录组数据的联合分析,发现它们表达变化的基因呈现显著的正相关性,显示AtSYN4、AtSCC3和AtBMIs之间的在H2Aub1生物学过程中的功能相关性。AtSCC3、AtSYN4和H2Aub1 ChIP-seq结果分析表明,AtSYN4、AtSCC3和H2Aub1多结合在转录起始位点(TSS)附近。AtSYN4/AtSCC3的信号主要在TSS上游约100bp处富集,而H2Aub1的信号主要富集在TSS下游约250bp处。此外,atbmi突变体中H2Aub1水平下降的基因与AtSYN4/AtSCC3富集的基因有显著交集。AtSCC3/AtSYN4-ChIP-seq数据还显示二者的结合位点都显著富集G-box (CACGTG)核心基序。酵母单杂交等实验证实AtSYN4可以直接结合含有G-box的DNA序列,而AtSCC3亚基则不能直接结合G-box基序。在atsyn4突变体中,AtSCC3和H2Aub1在含有G-box基序位点的富集度显著降低。
综上,该研究首次揭示了拟南芥cohesin在H2Aub1靶向特定基因组位点中的作用,即cohesin的AtSYN4亚基直接与含有G-box基序的DNA结合,而cohesin的AtSCC3亚基与PRC1中的泛素连接酶AtBMI1A/B/C亚基发生直接相互作用,进一步通过AtSYN4与AtSCC3间的相互作用将这些泛素连接酶桥接到基因组上含G-box基序的位点,介导这些位点的核小体中组蛋白H2A发生单泛素化修饰(图1)。
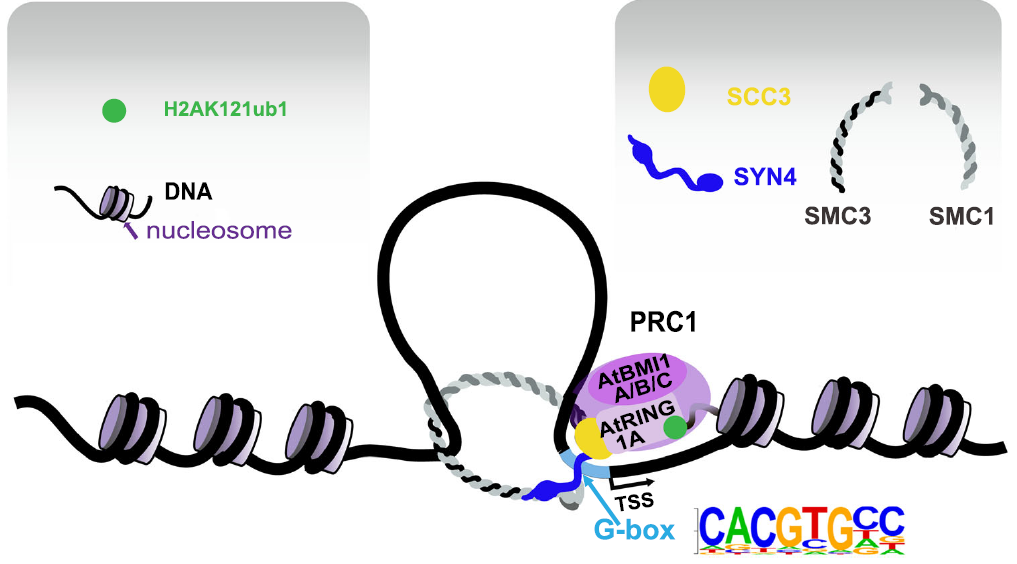
图1. H2Aub1通过cohesin蛋白亚基AtSYN4和AtSCC3特异性地靶向含G-box基序的基因组位点的分子模型
bat365在线平台官网出站博士后张雨、博士研究生马敏以及同济大学生命科学与技术学院毕业研究生刘孟、bat365在线平台官网博士后孙爱清为文章共同第一作者。bat365在线平台官网方玉达教授和涂晓雨副教授以及同济大学生命科学与技术学院江赐忠教授为共同通讯作者。该研究得到了国家自然科学基金以及上海市“超级博士后”激励计划的资助。
原文链接:https://doi.org/10.1038/s41467-023-36788-3





 loading......
loading......